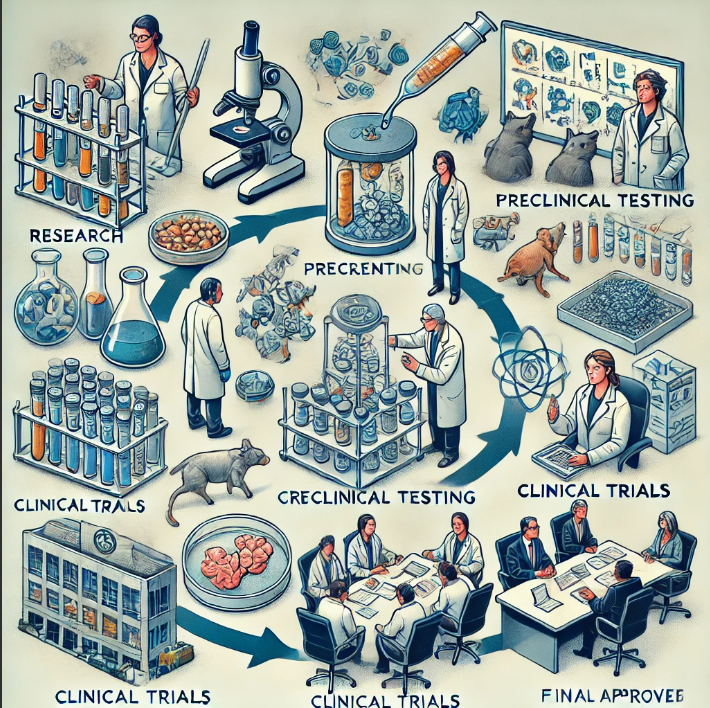
El desarrollo de medicamentos es un pilar fundamental en el avance de la medicina moderna y la mejora de la salud pública a nivel global. Este proceso, que puede extenderse más allá de una década y requerir inversiones multimillonarias, es esencial para la introducción de nuevas terapias que puedan prevenir, tratar o curar enfermedades que afectan a millones de personas en todo el mundo. En este artículo, exploraremos en profundidad las etapas críticas del desarrollo de un medicamento, los desafíos asociados y cómo cada fase contribuye a garantizar que los fármacos sean seguros, eficaces y de la más alta calidad.
¿Qué es un medicamento?
Un medicamento es una sustancia o combinación de sustancias destinadas a prevenir, diagnosticar, tratar o aliviar los síntomas de enfermedades. Está compuesto por uno o más principios activos, conocidos como fármacos, que son los responsables de ejercer la acción terapéutica en el organismo. Los medicamentos también contienen excipientes, sustancias inactivas que facilitan la administración, estabilidad y absorción del fármaco, sin poseer propiedades terapéuticas propias. La formulación adecuada de un medicamento es crucial para asegurar su eficacia y seguridad al ser administrado a los pacientes.
Etapas del desarrollo de un medicamento
El proceso de desarrollo de un medicamento puede durar más de 10 años y sigue una secuencia rigurosa de fases, cada una diseñada para garantizar la seguridad y eficacia del tratamiento.
1. Investigación básica
La investigación básica es el punto de partida en la búsqueda de nuevos medicamentos. En esta fase, científicos y investigadores estudian los mecanismos biológicos y moleculares de enfermedades para identificar posibles dianas terapéuticas. Mediante técnicas de biología molecular, bioquímica y genética, se descubren nuevos compuestos o moléculas que pueden interactuar con procesos biológicos clave. A menudo, se analizan miles de compuestos en bibliotecas químicas utilizando métodos de cribado de alto rendimiento para identificar «candidatos» prometedores. Sin embargo, de cada 10,000 moléculas estudiadas, solo alrededor de 250 avanzan a la siguiente etapa, lo que refleja la alta tasa de descarte en esta fase inicial.
2. Investigación preclínica
En la investigación preclínica, los compuestos candidatos se someten a pruebas rigurosas en modelos in vitro (en laboratorio) y in vivo (en animales) para evaluar su seguridad y eficacia. Los estudios preclínicos se centran en:
- Farmacodinamia (PD): Cómo actúa el fármaco en el organismo y su efecto biológico.
- Farmacocinética (PK): Cómo el organismo absorbe, distribuye, metaboliza y excreta el fármaco.
- Toxicología: Evaluación de efectos tóxicos, dosis letales, carcinogenicidad y genotoxicidad.
- Estudios de dosis-respuesta: Para determinar la dosis óptima que equilibra eficacia y seguridad.
Esta fase es crucial para identificar posibles riesgos y efectos adversos antes de probar el fármaco en humanos. Solo un pequeño porcentaje de los compuestos probados durante la fase preclínica demuestran un perfil de seguridad y eficacia adecuado para avanzar a los ensayos clínicos.
3. Investigación clínica
La investigación clínica es el proceso de probar el medicamento en humanos y se divide en cuatro fases principales:
- Fase I:
- Se administra el fármaco a un pequeño grupo de voluntarios sanos (normalmente de 20 a 100) para evaluar su seguridad, tolerabilidad, farmacocinética y farmacodinamia. El objetivo es determinar la dosis segura y observar posibles efectos secundarios inmediatos.
- Fase II:
- Se amplía el estudio a un grupo más grande de pacientes (de 100 a 500) que padecen la enfermedad objetivo. Esta fase busca evaluar la eficacia terapéutica del fármaco, refinar la dosis óptima y seguir monitoreando su seguridad. Se realizan estudios controlados para comparar el fármaco con placebos o tratamientos estándar.
- Fase III:
- En esta fase pivotal, se llevan a cabo ensayos clínicos a gran escala (de 1,000 a 5,000 pacientes o más) para confirmar la eficacia y seguridad del medicamento en poblaciones más amplias y diversas. Los ensayos son multicéntricos y, a menudo, internacionales. Los datos obtenidos son fundamentales para establecer el perfil beneficio-riesgo y son esenciales para la solicitud de autorización de comercialización.
- Fase IV (Postcomercialización):
- Después de que el medicamento ha sido aprobado y comercializado, continúa la vigilancia de su seguridad y eficacia en la población general. Esta fase permite identificar efectos adversos raros o a largo plazo que no se detectaron en los ensayos clínicos previos.
4. Autorización de comercialización
Para que un medicamento pueda ser comercializado, es necesario obtener la aprobación de las autoridades regulatorias competentes, como la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), la Agencia Europea de Medicamentos (EMA) o la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA). El proceso implica la presentación de un expediente completo que incluye datos de calidad, preclínicos y clínicos. Las agencias evalúan si el medicamento cumple con los estándares de seguridad, eficacia y calidad necesarios.
5. Vigilancia postcomercialización
Fabricación y Control de Calidad
Una vez autorizado, el medicamento debe ser producido en instalaciones que cumplan con las Buenas Prácticas de Fabricación (BPF). Se implementan estrictos controles de calidad en cada etapa de la producción para asegurar que cada lote del medicamento sea consistente y cumpla con las especificaciones establecidas.
Vigilancia Postcomercialización
La farmacovigilancia es esencial para monitorear la seguridad del medicamento en el mercado. Los profesionales de la salud y los pacientes pueden reportar efectos adversos a las autoridades sanitarias. Esta información es vital para actualizar las recomendaciones de uso y, si es necesario, implementar medidas regulatorias adicionales.
Importancia de la regulación y aprobación de medicamentos
La regulación de medicamentos es crucial para asegurar que estos productos sean eficaces y seguros para la población. Todas las etapas del proceso, desde la investigación básica hasta la vigilancia postcomercialización, son necesarias para minimizar riesgos y ofrecer tratamientos que realmente mejoren la salud de las personas.
En España, la AEMPS es responsable de evaluar y autorizar la comercialización de medicamentos, verificando que cumplan con estrictos estándares de calidad, seguridad y eficacia.
Desafíos en el Desarrollo de Medicamentos
El desarrollo de medicamentos enfrenta numerosos desafíos:
- Costos Elevados: Se estima que desarrollar un nuevo medicamento puede costar más de mil millones de euros, considerando los recursos invertidos en investigación, desarrollo y ensayos clínicos.
- Tiempo Prolongado: El proceso completo puede tardar de 10 a 15 años, lo que retrasa la disponibilidad de tratamientos innovadores.
- Fracaso en Etapas Avanzadas: Muchos fármacos que llegan a fases clínicas avanzadas pueden fracasar debido a problemas de seguridad o eficacia insuficiente.
- Regulaciones Estrictas: Aunque necesarias, las regulaciones pueden añadir complejidad y tiempo al proceso de desarrollo.
Innovaciones y Tendencias Actuales
La industria farmacéutica está adoptando nuevas tecnologías y enfoques para mejorar el desarrollo de medicamentos:
- Medicina Personalizada: El uso de la farmacogenómica permite diseñar tratamientos adaptados al perfil genético de cada paciente, aumentando la eficacia y reduciendo efectos adversos.
- Inteligencia Artificial y Big Data: Estas herramientas ayudan a identificar nuevas dianas terapéuticas, optimizar diseños de ensayos clínicos y predecir resultados.
- Terapias Avanzadas: Incluyen terapia génica, terapia celular y productos de ingeniería tisular, ofreciendo nuevas posibilidades para tratar enfermedades hasta ahora incurables.
Medicamentos Innovadores y Genéricos
Los medicamentos innovadores son aquellos que contienen nuevos principios activos y ofrecen avances terapéuticos significativos. Están protegidos por patentes que otorgan exclusividad de mercado por un período determinado (generalmente 20 años desde la fecha de la solicitud de la patente). Al expirar la patente, otras compañías pueden producir medicamentos genéricos, que contienen el mismo principio activo y tienen la misma eficacia y seguridad, pero a un costo menor debido a que no requieren repetir todo el proceso de investigación y desarrollo.
Medicamentos Biológicos y Biosimilares
Los medicamentos biológicos son productos complejos obtenidos a partir de organismos vivos, como células o microorganismos. Incluyen proteínas terapéuticas, anticuerpos monoclonales, vacunas y hormonas. Debido a su complejidad molecular y al proceso de fabricación, los biológicos son más difíciles de caracterizar y producir que los medicamentos químicos tradicionales.
Los biosimilares son versiones altamente similares a un medicamento biológico ya autorizado (llamado medicamento de referencia). Aunque pueden existir pequeñas diferencias en las características fisicoquímicas debido a la variabilidad inherente de los procesos biológicos, los biosimilares deben demostrar, a través de estudios comparativos exhaustivos, que no existen diferencias clínicamente significativas en términos de seguridad, pureza y potencia.
Importancia de la Regulación y Aprobación de Medicamentos
La regulación rigurosa de medicamentos es esencial para proteger la salud pública. Las agencias regulatorias desempeñan un papel crítico al:
- Garantizar la Seguridad y Eficacia: Solo se aprueban medicamentos que han demostrado beneficios significativos en relación con sus riesgos.
- Supervisar la Calidad de Fabricación: Aseguran que los medicamentos se produzcan bajo estándares estrictos.
- Monitorear la Seguridad Postcomercialización: Permiten la detección temprana de efectos adversos y la implementación de medidas correctivas.
En España, la AEMPS es la autoridad competente que evalúa y autoriza medicamentos, asegurando que los tratamientos disponibles para los pacientes sean seguros y eficaces.
Conclusión
El desarrollo de medicamentos es un proceso complejo y vital que requiere colaboración entre científicos, médicos, reguladores y la industria farmacéutica. Aunque presenta desafíos significativos en términos de costos, tiempo y riesgo, es fundamental para el progreso médico y la mejora de la salud global. Los avances tecnológicos y científicos continúan impulsando innovaciones que pueden transformar el panorama terapéutico.
Como sociedad, es importante reconocer y valorar el esfuerzo y la inversión necesarios para llevar un medicamento desde el laboratorio hasta el paciente. La comprensión de este proceso nos permite apreciar la importancia de la investigación científica, la regulación estricta y la necesidad de apoyar iniciativas que promuevan el desarrollo de nuevos tratamientos que puedan salvar vidas y mejorar la calidad de vida de las personas en todo el mundo.
Referencias
Notion [Internet]. Notion.site. [cited 2024 Oct 22]. Available from: https://jewel-calculator-aa3.notion.site/Proceso-de-desarrollo-de-medicamentos-1265f3fcdd858055871fd33d315fac05?pvs=4